Die Vergabe der Nobelpreise in den naturwissenschaftlichen Disziplinen haben selten politische Tragweite, verglichen beispielsweise mit dem Friedensnobelpreis. Barak Obama erhielt diesen 2009, nachdem er erst kurz im Amt war. Wahrscheinlich hatte er dadurch noch nicht ausreichend Zeit sich als Kandidat zu disqualifizieren. Obama selbst meinte, er habe den Preis nicht verdient. Oder Yasser Arafats Friedensnobelpreis 1994. Oder der für Al Gore 2007.
Das heißt natürlich nicht, dass die Nobelpreise in den Naturwissenschaften frei jeglicher politischen Dimension wären. Häufiger als die gewürdigten Wissenschaftler selbst, sind es aber eben jene, die unverständlicherweise leer ausgehen. 2009 erhielten Luc Montagnier und Françoise Barré-Sinoussi eine Hälfte des Medizinnobelpreises für die Entdeckung des AIDS-Erregers. Die Tatsache, dass Luc Montagnier auf dem besten Weg ist zur Galionsfigur der Pseudowissenschaften zu werden, ist das eine. Wieso aber Robert Gallo, einer der Mitentdecker des HI-Virus, nicht gewürdigt wurde, bleibt das Geheimnis des Nobelkomitees des Karolinskainstituts, das den Preis für Physiologie und Medizin vergibt.
Die diesjährige Vergabe des Nobelpreises weist vermeintliche Parallelen zu dem Fall Gallo auf. Neben Shin’ya Yamanaka, dem Erfinder der Reprogrammierung von Körperzellen zu iPS Zellen, wurde John Gurdon gewürdigt. Zunächst hat Gurdon mit der Reprogrammierung von Zellen durch Transkriptionsfaktoren, wie sie Yamanaka gelungen ist, wenig zu tun. Er ist der Vater von inzwischen klassischen Experimenten, bei denen einer entkernten Eizelle der Zellkern einer Körperzelle eingesetzt wird. Wenn diese Zellchimären sich anfangen zu teilen, können die so generierten Embryonen zu lebensfähigen Tieren heranwachsen. Die gesamte Information, die zur Entwicklung notwendig ist, ist also auch in adulten Zellen noch vorhanden. Gurdon führte diese Experimente mit Froscheiern durch.
Bekannter sind jedoch die analogen Versuche an Säugetieren, die erst Jahrzehnte später gelangen: Mit dieser Technik wurde am Roslin-Insititut in Edinburgh 1996 das erste „Klonschaf Dolly“ hergestellt. Warum also ist nicht auch Ian Wilmut, der „Vater von Dolly“ mit dem Nobelpreis ausgezeichnet worden? Immerhin erlauben es die Nobelpreisstatuten, dass sich bis zu drei Wissenschaftler einen Preis teilen. Nun, der tatsächliche Beitrag von Wilmut zu den Zellkerntransferexperimenten aus denen letztlich Dolly resultierte, ist umstritten und inzwischen wird Wilmuts Kollege, der weitgehend unbekannte Keith Campbell als geistiger Vater von Dolly angesehen. Der Streit eskalierte bis hin zur öffentlichen Forderung, dass Ian Wilmut die von der Queen verliehene Ritterwürde wieder abgenommen wird.
Wäre also auch der Kerntransfer in Säugetieren nobelpreiswürdig gewesen, hätte Keith Campbell die Ehre gebührt und nicht Ian Wilmut. Ich hätte es Campbell gegönnt, sozusagen als Wiedergutmachung. Solche Argumente scheinen jedoch in Stockholm nicht zu zählen.
Schlagwort: iPS
-

Warum Ian Wilmut für das Klonschaf Dolly keinen Nobelpreis bekommt
-
Die biologische Uhr zurück drehen. Nobelpreis für die Reprogrammierung von Stammzellen
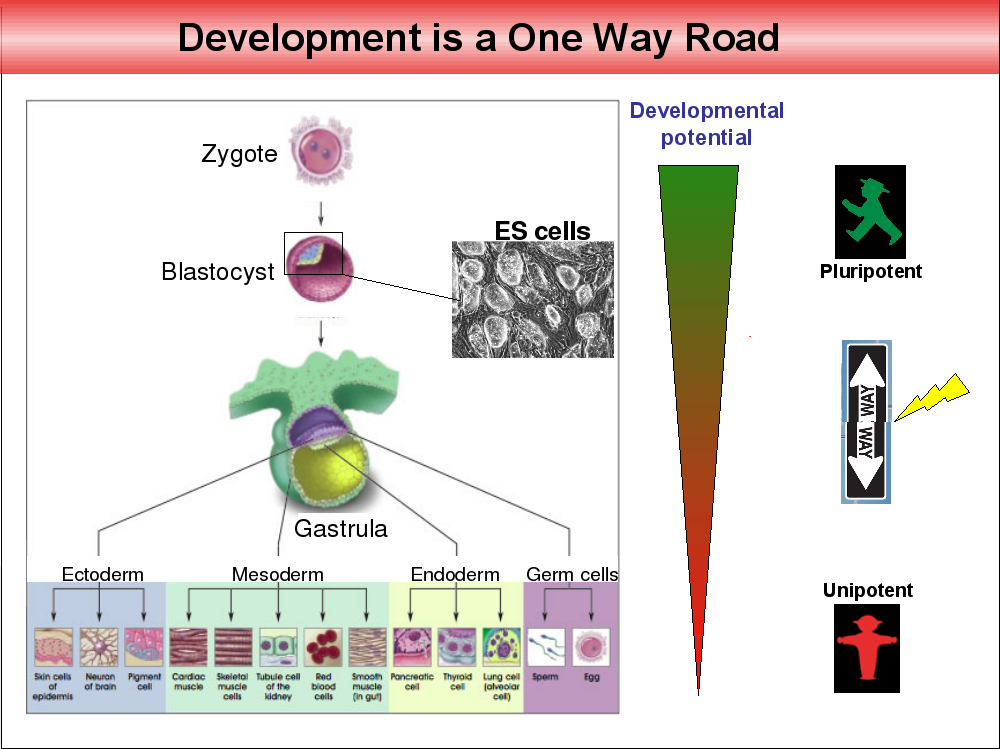
Es gibt über 200 verschiedene Zelletypen im menschlichen Körper. Hautzellen, rote Blutkörperchen, Nervenzellen, Darmepithelzellen, Herzmuskelzellen, und so weiter. Vier Tage nach Befruchtung fangen die Zelltypen an, sich zu differenzieren, nach zwei Wochen sind Ectoderm, Mesoderm, Endoderm und die Geschlechtszellen angelegt, zwei Monate nach der Befruchtung sind die unterschiedlichen Zelltypen größtenteils ausdifferenziert. Lange wurde angenommen, dass dieser zelluläre Entwicklungsprozess einer Einbahnstraße gleicht, der mit pluripotenten Zellen beginnt, Zellen also, die das Potential haben, sich in viele verschiedene Zelltypen zu differenzieren, und in unipotenten, ausdifferenzierten Zellen mit einer definierten Funktion endet.
Erst vor ein paar Jahren gelang es Shin’ya Yamanaka diesen Prozess der Ausdifferenzierung umzukehren. Er konnte Bindegewebszellen von Mäusen in Labor durch Gabe bestimmter Transkriptionsfaktoren (sie heißen Oct3/4, Sox2, Klf4 und c-Myc) in einen Zustand überführen, in dem die Zellen sich erstaunlicherweise wieder in andere Zelltypen ausdifferenzieren liesen. Die biologische Uhr der Differenzierung wurde sozusagen zurück gedreht. Die so geschaffenen Zellen wurden induzierte pluripotente Stammzellen, oder iPS-Zellen getauft.
Diese erstaunlichen Ergebnisse wurden inzwischen von vielen Laboren bestätigt und erweitert. Es werden immer weitere Möglichkeiten entdeckt, differenzierte Zelltypen in deren Vorläuferzellen zurück zu verwandeln oder bestimmte Zelltypen ineinander umzuwandeln. Die Methoden werden verfeinert und Stück für Stück werden so die molekularen Grundlagen der Zellentwicklung aufgedeckt.
Hoffnungen für den therapeutischen Nutzen von iPS-Zellen werden ebenfalls an die induzierten pluripotenten Stammzellen geknüpft. Beispielsweise wäre es denkbar, körpereigene Haut für Brandopfer oder neue Herzmuskelzellen für Infarktpatienten aus iPS Zellen herzustellen. Nicht zuletzt wurde die Entdeckung der Reprogrammierung von Gegnern der Forschung an embryonalen Stammzellen als ein Argument ins Feld geführt, dass man auf richtige Stammzellen nun ja in der Forschung verzichten könne. Experten sind anderer Meinung.
Der diesjährige Nobelpreis für Physiologie und Medizin wurde zurecht an Shin’ya Yamanaka verliehen. Seine Forschung steht für einen wissenschaftlichen Paradigmenwechsel mit noch unabsehbaren Konsequenzen, inklusive therapeutischer Anwendungen. Zum zweiten Preisträger dieses Jahr, John Gurdon, mehr heute Nachmittag.
Die Abbildung oben stammt aus einem Vortrag von Konrad Hochedlinger.